
Theorie der trockenen Destillation des Holzes
Bei der Destillation des Holzes im größeren Maßstabe kann man drei Perioden unterscheiden. In der ersten, bis etwa 170° reichenden Phase wird das im Holz enthaltene Wasser abdestilliert; es findet eine geringe Zersetzung des Holzes statt. Darüber hinaus bis gegen 270 °C spielt sich die zweite Phase ab, in welcher die Zersetzung des Holzes unter reichlicher Entwicklung von Gasen (hauptsächlich C02 und CO) und wässerigen Destillaten einsetzt. Oberhalb dieser Temperatur erfolgt in der dritten Phase eine lebhafte exothermische Reaktion, deren Wärmeentwicklung genügt, um fast ohne weitere Wärmezufuhr die Destillation zu Ende zu führen, wobei die Holzkohle entsteht und Teer überdestilliert.
Die meisten chemischen Verbindungen, die bei der trockenen Destillation des Holzes primär entstehen, sind bei der Destillationstemperatur nicht unzersetzt flüchtig. Sie werden daher mehr oder weniger zersetzt, u. zw. in einem Grade, der von der Temperatur, der Zeit der Erhitzung, dem Druck im Apparat und dem Partialdruck des betreffenden Körpers abhängt Will man daher nach Möglichkeit den primären Verlauf der trockenen Destillation herausfinden, so muß man eine ganz geringe Menge bei höchstem Vakuum (Kathodenlicht) destillieren, u. zw. bis 400°; denn über dieser Temperatur entstehen hauptsächlich Gase, die auch beim gewöhnlichen Druck beständig sind. Unter diesen Umständen destilliert auch das Pech über, und man erhält z. B. für Birkenholz etwa folgende Reaktionsgleichung:
Wird anstatt im Vakuum bei gewöhnlichem Druck und sehr langsam (etwa 14 Tage) destilliert bis 100°, so wird das Pech fast völlig zersetzt, u. zw. nach der Gleichung:
C30H3O15 = 4 C7H4O + 7 H2O + 2 CO2
Pech31,1% = Kohle26,6% —6,2% —-4,3»«
Die Ausbeute an Kohle und Teer kann somit je nach den bei der praktischen Ausführung der Destillation innegehaltenen Bedingungen variieren, während dagegen der Betrag von Essigsäure und Methylalkohol für dieselbe Holzgattung fast konstant ist, weil diese Körper bei Temperatur und Partialdruck der trockenen Destillation beständig sind; doch wird ein kleiner Teil der Essigsäure in Aceton übergeführt. Die Ameisensäure wird dagegen mehr oder weniger zersetzt, je nach der Zeit, während welcher sie überhitzt wird. Es ist weiter zu bemerken, daß faules Holz wesentlich weniger Essigsäure gibt als frisches. Wirtschaftlich ist auch von großer Wichtigkeit, daß Nadelholz nur etwa halb so viel Essigsäure und Methylalkohol liefert wie Laubholz (Buche, Birke), dagegen etwa 2% mehr Kohle.
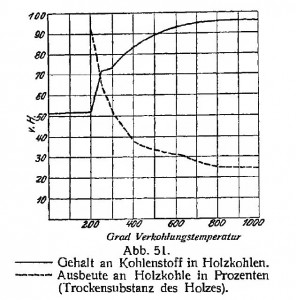 Der Kohlenstoffgehalt der Holzkohlen und die Ausbeute an diesen hängt wesentlich von der Endtemperatur bei der Destillation ab, wie nebenstehende Tabelle und Kurve (Abb. 51) angeben. Wie früher erwähnt, ist beides abhängig von der Geschwindigkeit, mit welcher eine bestimmte Menge Holz durch das Temperaturintervall 250—400 °C geht; aber unter den in der Praxis bestehenden Verhältnissen ist dieser Unterschied nur gering.
Der Kohlenstoffgehalt der Holzkohlen und die Ausbeute an diesen hängt wesentlich von der Endtemperatur bei der Destillation ab, wie nebenstehende Tabelle und Kurve (Abb. 51) angeben. Wie früher erwähnt, ist beides abhängig von der Geschwindigkeit, mit welcher eine bestimmte Menge Holz durch das Temperaturintervall 250—400 °C geht; aber unter den in der Praxis bestehenden Verhältnissen ist dieser Unterschied nur gering.
Die Destillation fängt somit erst bei etwa 200 °C an. Bei 250 °C werden die Rotkohlen erhalten mit einem Gehalt von etwa 70% C und 5% H. Bei etwa 300 °C hat die Reaktion die größte Intensität. Wenn die Kohlen beim Brennen nicht riechen sollen, muß wenigstens bis 350 °C ernitzt werden. Bei etwa 400 °C erhält man die Retortenkohlen, die gewöhnlich etwa der Formel C7H4O entsprechen, mit einem Gehalt von 80,8% C, 3,8% H und 15,4% O. Diese Kohlen sind hartklingend und schwarz, mit derselben Struktur wie das Holz. Ihre Verbrennungswärme ist etwa 7800 Cal. Die Kohlen des Laubholzes sind spezifisch schwerer (etwa 17 kg pro 1 hl) als Nadelholzkohlen (etwa 13 kg pro 1 hl). Der Aschegehalt ist etwa 1 %. Der Feuchtigkeitsgehalt der lufttrockenen Holzkohle ist etwa 8%.
Wenn lufttrockenes Holz in Mengen von etwa 1 kg langsam und ohne Überhitzung bis höchstens 400° destilliert wird, verläuft die Reaktion derart, daß man sie etwa durch folgende Gleichung darstellen kann:
2 C42H60O28 = 3 C16H10O2 + 28 H2O + 5 CO2 + 3 CO + 2 CH3COOH + C23H20O4
Holz ————Holzkohle ————————————————Teer
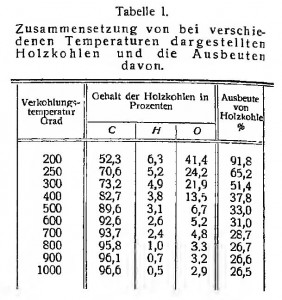
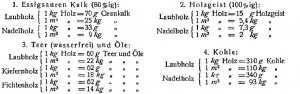
Nach dieser Gleichung bildet sich aus trockenem Holz an Holzkohle 34,8%, an Wasser 24,9%, an Kohlendioxyd 10,9%, an Kohlenoxyd 4,1%, an Essigsäure 5,9 % an Methylalkohol 1,5%, an Teer 17,7%. Doch ist hierzu zu bemerken, daß man aus Laubholz etwas mehr Essigsäure und Methylalkohol, aus Nadelholz etwas weniger erhält, dafür aus letzterem etwa um 2% mehr Kohle. Beim Verkohlen in großem Maßstabe erhält man immer viel weniger Teer, als hier angegeben ist. Je größer die Chargen sind, desto weniger Teer bekommt man; denn desto längere Zeit dauert die Überhitzung. Essigsäure und Methylalkohol sind viel weniger empfindlich gegen Überhitzen. Aus dem Gesagten und aus dem Grade der Frische des Holzes erklären sich wohl die in der Praxis beobachteten Unterschiede der Ausbeuten. In der Praxis erhält man aus trockenem, frischem Holz bei 400° etwa:
Wird die Destillation des Holzes bis etwa 500 °C getrieben, so werden Meilerkohlen erhalten, deren mittlere Zusammensetzung etwa durch die Formel C16H6O ausgedrückt werden kann, welcher 89,7 % C 2,8% H und 7,5% O entsprechen. Die Meilerkohlen ähneln dem Anthrazit, die Retortenkohlen den Steinkohlen. Diese letzten sind aber viel wasserstoffreicher.
Die Holzkohlen bestehen daher aus 2 Bestandteilen: primärer Holzkohle und Teerkoks, was auch aus der erst angeführten Gleichung hervorgeht. Bei 500° hat sich die Sache ausgeglichen. In dem einen Fall haben sich bei der Temperaturerhöhung von 400 auf 500 °C mehr Wasserstoff bzw. wasserstoffreichere Kohlenwasserstoffe gebildet.
Es ist zu bemerken, daß bei der Destillation bis 500 °C (Meilerkohlen) die Festigkeit der Kohlen erhöht wird. Deswegen, und weil die Gase, die die Kohlen zwischen 400 — 500 °C ausgeben, im Hochofen nur wenig nutzbar sind, wird die Meilerkohle bei dem Hochofenprozeß mehr geschätzt als die Retortenkohle. Man vermischt daher fast immer Retortenkohlen und Meilerkohlen.
Die Holzkohlen haben wesentlich andere chemische Eigenschaften als der reine Kohlenstoff. Schon bei 40 °C tritt in der Luft langsame Verbrennung von Retortenkohlen ein, deren Geschwindigkeit natürlich mit der Temperatur sehr zunimmt; bei 300 °C ist sie etwa 20mal so groß wie bei 100 °C. Deswegen müssen die Kohlen vor dem Zutritt der Luft gut abgekühlt bzw. mit Wasser gelöscht werden. Interessant ist dabei, daß die Verbrennung in 2 zeitlich getrennten Phasen verläuft, deren erste eine direkte chemische Bindung von Sauerstoff ist. So können die Kohlen in einer abgegrenzten Menge Luft den Sauerstoff bei 100 °C in 24 h völlig absorbieren. Ein kleiner Teil von ihm wird dabei allerdings in Kohlendioxyd übergeführt, aber der größte Teil bleibt in den Kohlen chemisch gebunden; der Gehalt an Sauerstoff in den Kohlen nimmt zu. So nahm z. B. eine Probe Retortenkohle bei etwa 105 °C in 14 Tagen etwa 4,5 % an Gewicht zu. Die Kohlen hatten nebenstehende Zusammensetzung.
| Vor der Erhitzung | Nach der Erhitzung | |
| Kohlenstoff | 77,7 % | 72,4 % |
| Wasserstoff | 4,5 % | 3,6 % |
| Sauerstoff u. a. | 17,8 % | 24,0 % |
Es ist somit deutlich, daß Retortenkohlen sich in hohem Grade wie ein ungesättigter autoxydabler Körper verhalten. Daß der absorbierte Sauerstoff einen Peroxydcharakter hat, ist wahrscheinlich und wird auch von Engler und Weissberg (Kritische Studien über die Vorgänge der Autoxydation, 1904) angenommen. Kohlen können daher als Sauerstoffüberträger dienen, was auch vielfach beobachtet worden ist. Am bekanntesten ist die Aldehydbildung bei der Kohlenfiltrierung des Branntweins.
Wie zu erwarten war, ist die Empfindlichkeit der Meilerkohlen bei niedrigen Temperaturen geringer als die der Retortenkohlen, von etwa 250 °C an aber ebenso groß.
Die Reaktion zwischen Holzkohlen und Kohlendioxyd und Wasserdampf verläuft mit viel größerer Geschwindigkeit, als wenn Steinkohlenkoks benutzt wird. Die Reaktion fängt aber bei etwa derselben Temperatur an, etwas unter 500°. Der Unterschied beruht daher auf der viel größeren Oberfläche der Holzkohlen.
Die Gleichgewichtslage CO2 + C ↔ 2 CO wird bekanntlich bei steigender Temperatur und mit negativer Wärmebildung nach rechts verschoben. Umgekehrt sollte sie bei sinkender Temperatur und positiver Wärmebildung nach links verschoben werden. Kohlenoxyd ist aber bei jeder Temperatur beständig. Erhitzt man aber Kohlenoxyd zusammen mit Holzkohle auf 400 °C, so wird es langsam nach der Reaktion CO2 + C ↔ 2 CO in Kohlendioxyd und Kohle übergeführt, welche Reaktion fortgehen wird, bis das Gleichgewicht erreicht worden ist, also bis der allergrößte Teil in Kohlendioxyd und Kohle übergeführt ist, da ja die entgegengesetzte Reaktion bei dieser Temperatur kaum merkbar ist
Die eben erwähnten Reaktionen haben wenig oder keine Bedeutung für den Destillationsprozeß in Retorten; wenn es sich aber um Verkohlung in Meilern handelt, müssen sie eine Rolle spielen. Der Luftzutritt ist dabei nicht gänzlich verhindert. Die Meilergase bewegen sich. Es müssen sich somit Stellen vorfinden, wo die Kohlen durch Sauerstoffaufnahme oxydiert, andere, wo die oxydierten Kohlen wieder zersetzt werden, und schließlich Stellen, wo die Reaktion CO2 + C ↔ 2 CO vor sich geht. In der Tat wurden bei der früher erwähnten, sehr langsamen Verkohlung in der Retorte während 14 Tage bis 400 °C nur 2,1 % vom Gewicht des Holzes an Kohlenoxyd erhalten, während sonst dessen Menge etwa 3,5% beträgt-
Die Holzkohlen, besonders die aktiven Kohlen (s. diese unter Kohlenstoff), adsorbieren Oase, und zwar umsomehr, je niedriger die Temperatur ist. Bei der Temperatur der flüssigen Luft ist die Verdichtung sogar von Wasserstoff so vollständig, daß man auf diese Weise das höchstmögliche Vakuum erreichen kann.
Der Methylalkohol des Holzgeistes stammt aus den Methoxylgruppen des Lignins, und zwar entsteht er durch Verseifung aus ihnen. Deswegen wird sein Gehalt etwas erhöht, je langsamer man destilliert. So wurde erhalten, auf völlig ausgetrocknetes Birkenholz gerechnet, bei:
| 5 mm Druck und 3 Stunden Verkohlung | Atmosphärendruck und 8 Stunden Verkohlung | Atmosphärendruck und 14 Tagen Verkohlung |
| 1,2 % | 1,49 % | 1,77 % |
Buchenholz gibt etwa dieselbe Menge, Fichte und Föhre liefern etwa 0,9%. Die Essigsäure entsteht sowohl aus der Cellulose und Hemicellulose wie aus dem Lignin, im letzten Falle, wie gesagt, aus seinem Acetylkomplex. Frisches Holz von Birke gibt etwa 7%, Buche 6%, Fichte 3,2% und Föhre 3,5% Essigsäure.
Der Teer stammt teils aus den Kohlenhydraten, teils aus dem Lignin.
Nach Erdmann und Schaefer gibt Cellulose bei der trockenen Destillation Furfurol, Oxymethylfurfurol, Maltol, γ-Valerolacton und Formaldehyd. Nach Wichelhaus entsteht auch eine sehr kleine Menge Phenol, aber kein Kresol oder andere aromatische Verbindungen. Die Produkte sind somit im großen und ganzen von aliphatischem Charakter wie die Kohlenhydrate selbst. Ein ganz anderes Resultat bekommt man bei der trockenen Destillation von Lignin. So gab das Fichtenlignin bei dieser außer Essigsäure und Methylalkohol nur aromatische Verbindungen, und zwar außer den 3 Kresolen Kreosol und seine Homologen Äthyl- und n-Propylkreosol, sämtlich mit der Stellung 1, 3, 4, also derselben Stellung wie im Coniferylalkohol und in der Protocatechusäure. M. Nencki und N. Sieber haben dieselben Phenole aus Nadelholzteer erhalten. Die Resultate bestätigen somit völlig die erwähnte Annahme über die chemische Konstitution dieses Lignins.
In Buchenholzteerkreosot sind nachgewiesen:
- p-Kresol OH – C6H4 –CH3
- Phlorol OH – C6H4 – C2H5 (2)
- Guajacol OH – C6H4 – OCH3 (2)
- Kreosol CH3 – C6H4 – OH(4) – OCH3 (3).
- Pyrogallussäure-dimethyläther C6H3 – OCH3 – OCH3 -OH (3)
- Methylpyrogallussäure-dimethyläther CH3 – C6H2 – OCH3 – OCH3 – OH
- Propylpyrogallussäure-dimethyläther C3H7 – C4H2 • OCH3 – OCH3– OH
Die Stellungsverhältnisse 1, 3, 4 kommen somit auch hier vor, aber auch die Stellung 1, 4, 5 in den Pyrogallussäurederivalen. Daß Buchenholz mehr Methylalkohol gibt als Nadelholz, ist darnach klar.
Insgesamt sind im Holzteer und in den übrigen Holzdestillationsprodukten etwa 175 verschiedene Substanzen nachgewiesen worden. Eine ausführliche Zusammenstellung s. bei Bugge, Industrie der Holzdestillationsprodukte (S. 59 — 68).

Antworten